ГОСТ 23137-78
Группа В51
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРИПОИ МЕДНО-ЦИНКОВЫЕ
Copper-zinc solders. Grades
Дата введения 1980-01-01
Постановлением Государственного комитета стандартов Совета Министров СССР от 24 мая 1978 г. N 1385 срок введения установлен с 01.01.80
Ограничение срока действия снято по протоколу N 4-93 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 4-94)
1. Настоящий стандарт распространяется на припои медно-цинковые, применяемые для пайки, и устанавливает марки припоев.
2. Марки и химический состав припоев должны соответствовать требованиям, указанным в таблице.
Химический состав, % | ||||||
Наименование припоя | Основные компоненты | Примеси, | Примерное назначение |
|||
Свинец | ||||||
Медно-цинковый 36 | Остальное | Для пайки латуни, содержащей до 68% меди |
||||
Медно-цинковый 48 | Для пайки медных сплавов, содержащих меди свыше 68% |
|||||
Медно-цинковый 54 | Для пайки меди, томпака, бронзы и стали |
|||||
Примечание. По соглашению изготовителя с потребителем пределы содержания меди и содержание примеси свинца могут быть снижены.
3. Механические и физические свойства припоев приведены в приложении.
ПРИЛОЖЕНИЕ (справочное). Механические и физические свойства медно-цинковых припоев
ПРИЛОЖЕНИЕ
Справочное
Механические и физические свойства медно-цинковых припоев
Температура плавления, °С | Плот- | Коэффициент линейного расширения х10 | Удельное электросопро- | Предел прочности при растяжении , МПа (кгс/мм) | Относи- | Твер- |
||
ликвидус | солидус | |||||||
Электронный текст документа
подготовлен ЗАО "Кодекс" и сверен по:
официальное издание
Цветные металлы. Медь. Технические условия.
Марки: Сборник ГОСТов. -
М.: Издательство стандартов, 2000
Имеется много конструкций медно-цинковых элементов. Все они носят имена своих конструкторов. Есть элементы типа Мейдингера, Калло, Локвуда, Томсона и др. Но все эти элементы схожи по внешнему оформлению и почти одинаковы по принципу своего действия.
Из этих конструкций наиболее прост в изготовлении эле-мент типа Калло. Вместе с этим медно-цинковый элемент типа Калло вполне может быть применен для питания ламп накала радиоприемника для питания электромотора и про-изводства всевозможных опытов в лаборатории.
Для постройки такого элемента требуется сосуд. Жела-тельно, чтобы он был значительно больше чайного стакана. Для этого сосуд можно отрезать от литровой бутылки. . Можно применить для постройки нашего элемента и пол-литровую стеклянную банку из-под консервов или соуса. Затем потребуется кусок толстого медного одножильного изолированного провода - гуппера сантиметров 30 длиной, цинковая пластинка, медный купорос.
Из медной проволоки длиной 30 см надо свернуть спи-раль. Предварительно с проволоки счищается изоляция, но не вся-она оставляется на проводе длиной в 15 см. Из очищенного проводника и свертывается спираль с таким расчетом, чтобы она могла поместиться в наш сосуд. Остав-шийся изолированный конец провода сгибается под прямым углом по отношению к спирали - это будет отвод от поло-жительного полюса элемента. Можно его сделать также и из медной полосы шириной в 1 см.
Цинковая пластинка вырезается в виде круга или прямо-угольная, но вместе с отводом и лапкой, то-есгь с узкой полоской в 1 см шириной и 6-8 см длиной - это будет отвод от отрицательного полюса элемента, и с другой поло-ской такой же ширины и в 5-6 см длины-лапкой для под-вешивания. Можно для этого применить и цинковый цилиндр высотой 2-3 см. По диаметру сосуда выпиливают из фанеры или из тонкой дощечки крышки. Желательно деревянную крышку элемента пропарафинить или покрыть с обеих сто-рон шеллаком. Это предохранит дерево от быстрой порчи, и такая крышка дольше будет служить нам. С двух противо-положных бортов крышки прорезаются небольшие отверстия для вывода электродов.
Теперь остается собрать элемент и зарядить его. На дно стакана кладется медная спираль и засыпается медным купо-росом, слоем в 1 см. Затем в сосуд наливается кипяченая остуженная вода приблизительно на две трети сосуда. Воду надо наливать очень осторожно, чтобы не тревожить кри-сталлы медного купороса.
Когда вода налита, в нее погружают цинковую пластинку так, чтобы она была покрыта слоем воды в 1 - 1,5 см. Лапки с отводом загибаются за борг стакана, и на него надевается крышка. См. рис. 21а.
Затем производится зарядка. Для этого элемент замыкают накоротко, то-есть соединяют проводником положительный полюс с отрицательными и оставляют в таком положении приблизительно на сутки. После этого элемент размыкают- и он готов к действию. Такой элемент будет давать напря-жение около 1 вольта.
Что же происходит при коротком замыкании элемента?
Как уже было сказано в вводной части статьи, при ко-ротком замыкании элемента потечет электрический ток, воз-никающий в результате химической реакции между электро-дами и электролитом. При этой реакции медный купорос будет разлагаться, выделяя серную кислоту. А так как сер-ная кислота значительно легче воды, она будет подниматься кверху. Вступая в реакцию с цинком, серная кислота обра-зует раствор цинкового купороса, который плотным слоем окутает цинковую пластинку. Этот раствор не будет опу-скаться и будет всегда держаться наверху в силу того, что он легче раствора медного купороса и воды. Все это создает необходимые условия для устойчивой работы элемента.
Преимущества такого элемента заключаются в том, что в нем исключается возможность коротких замыканий и он не выходит от этого из строя. Недостатком его является то, что элемент ни в коем случае не следует сотрясать, иначе в нем могут перемешаться растворы цинкового и медного купороса и элемент выйдет из строя. Некоторые неудобства составляет добавление в элемент медного купороса по мере его расходования. Уровень раствора медного купороса не дол-жен подниматься выше половины электролита. Добавлять медный купорос в элемент надо очень осторожно, по кри-сталлику, чтобы не возмутить растворы и не перемешать их. И третьим недостатком элемента Калло является его малая электродвижущая сила и большое внутреннее сопротивление. Поэтому для надежной работы батареи в 4 вольта придется соединять последовательно 5 элементов Калло.
Элемент Мейдингера отличается от элемента Калло тем, что для постоянного обеспечения элемента медным купоросом употребляется стеклянная воронка или перевернутое гор-лышко от бутылки (см. рис. 21 б). Устройство элементов Калло и Мейдингера показано на рис. 21.
Мы ужо знаем, что при любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю.
Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Здесь восстановитель - цинк - отдает электроны. Эта полуреакция выражается уравнением:
Окислитель - ион меди - принимает электроны. Уравнение этой полуреакции имеет вид:
В рассматриваемом примере обе полуреакции протекают в месте соприкосновения цинка с раствором, так что электроны непосредственно переходят от атомов цинка к ионам меди. Можно, однако, осуществить эту реакцию таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока - по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. При таком осуществлении окислительно-восстановительной реакции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами. Их называют также химическими источниками электрической энергии (сокращенно ХИЭЭ) или химическими источниками тока.
В технике гальваническими элементами принято называть только ХИЭЭ, в которых протекают практически необратимые реакции. Такие ХИЭЭ обычно нельзя перезаряжать: они предназначены для однократного использования (в один или несколько приемов). ХИЭЭ, в которых протекают практически обратимые реакции, называют аккумуляторами: их можно перезаряжать и использовать многократно.
Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление - на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи.
Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди (рис. 82). Этот элемент (элемент Якоби - Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала.
При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Направление движения ионов в растворе обусловлено протекающими у электродов электрохимическими процессами. Как уже сказано, у цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе и , движутся от цинкового электрода к медному, а анионы в обратном направлении. В итоге жидкость у обоих электродов остается электронейтральной. Схема движения электронов и ионов при работе медно-цинкового элемента показана на рис. 83.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный - катодом.
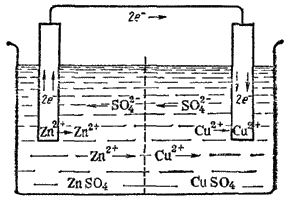
Рис. 82. Схема медно-цинкового гальванического элемента.
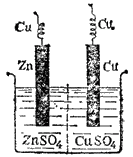
Рис. 83. Схема движения ионов и электронов при работе медно-цинкового гальванического элемента.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную, работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном - обратимом - проведении реакции (см. § 67). Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В медно-цинковом элементе при окислении одного эквивалента цинка и Одновременном восстановлении одного эквивалента ионов меди по цепи пройдет количество электричества, численно равное одному фарадею ( Кл/моль), так что полезная работа , которую ток может совершить, будет равна:
где V - напряженке между полюсами элемента.
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока ( - величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным. Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э. д. с.) данного элемента.
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
![]()
где - э. д. с. элемента.
Ясно, что при взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
получим уравнение, связывающее стандартную э. д. с. с константой равновесия реакции, протекающей в гальваническом элементе:
Измерения электродвижущих сил можно производить с высокой точностью. Эти измерения представляют собой один из наиболее точных методов определения стандартных энергий Гиббса, а следовательно, и констант равновесия окислительно-восстановительных реакций в растворах.
Окислительно-восстановительная реакция протекает в гальваническом элементе несмотря на то, что окислитель и восстановитель непосредственно друг с другом не соприкасаются. Для того чтобы понять, как это происходит, как возникает электродвижущая сила при пространственном разделении процессов окисления и восстановления, рассмотрим более детально явления, происходящие на границах раздела фаз в гальваническом элементе.
Прямые опыты с применением радиоактивных индикаторов Показывают, что если привести металл (М) в контакт с раствором его соли, то ионы металла переходят из металлической фазы в раствор и из раствора в металл. Поскольку энергетическое состояние ионов в этих фазах неодинаково, то в первый момент после установления контакта ионы металла переходят из металла в раствор и в обратном направлении с различной скоростью. Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд, а металлический электрод заряжается отрицательно. По мере увеличения этих зарядов переход катионов в одноименно заряженный раствор затрудняется, так что скорость этого процесса уменьшается, скорость же перехода катионов из раствора на отрицательно заряженный электрод возрастает. В результате скорости обоих процессов выравниваются и между металлом и раствором устанавливается равновесие:
При этом металлический электрод оказывается заряженным отрицательно, а раствор - положительно. Если при установлении контакта металл - раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор - отрицательно.
В элементе Якоби - Даниэля соответствующие равновесия устанавливаются между цинковым электродом и раствором сульфата цинка
а также между медным электродом и раствором сульфата меди:
В этом элементе имеются еще две границы раздела фаз: между растворами сульфатов цинка и меди, а также медью и цинком (см. рис. 82). Граница между растворами не оказывает существенного влияния ни на величину э. д. с., ни на протекание реакции при работе элемента.
Что же касается границы между металлами, то через нее могут проходить не ионы, как в случае границы металл- раствор, а электроны. И здесь вследствие неодинакового энергетического состояния электронов в меди и в цинке первоначальные скорости перехода электронов из одного металла в другой и в обратном направлении различны. Однако и в этом случае быстро устанавливается равновесие, при котором металлы также приобретают заряды противоположного знака:
Таким образом, при разомкнутой цепи на трех имеющихся в элементе Якоби - Даниэля границах раздела фаз устанавливаются равновесия, причем фазы заряжаются. В результате энергетическое состояние электронов на концах разомкнутой цепи-оказывается неодинаковым: на том медном проводнике, который соприкасается с цинковым электродом, энергия Гиббса электронов выше, а на том, который соединен с медным электродом, - ниже. Разность энергий Гиббса электронов на концах цепи и определяет э.д.с. данного элемента.
При замыкании внешней цепи электроны перемещаются от цинкового электрода к медному. Поэтому равновесия на фазовых границах нарушаются; происходит направленный переход ионов цинка из металла в раствор, ионов меди - из раствора в металл, электронов - от цинка к меди: протекает окислительно-восстановительная реакция.
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительновосстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и практически постоянная , возможность отбирания больших токов, длительная сохранность и ). Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. Например, в свинцовых аккумуляторах (см. § 189) электролитом служит раствор серной кислоты.
Почти во всех выпускаемых в настоящее время гальванических элементах анод изготовляется из цинка, а в качестве вещества для катода обычно применяются оксиды менее активных металлов.
Описание важнейших гальванических элементов см. § 214, аккумуляторов - пп. 189, 201, 244.
Химические источники электрической энергии применяются в различных отраслях техники. В средствах связи (радио, телефон, телеграф) и в электроизмерительной аппаратуре они служат источниками электропитания, на автомобилях, самолетах, тракторах применяются для приведения в действие стартеров и других устройств, на транспорте, в переносных фонарях с их помощью производится освещение.
Все обычные ХИЭЭ не свободны от двух недостатков. Во-первых, стоимость веществ, необходимых для их работы (например, свинца, кадмия), высока. Во-вторых, отношение количества энергии, которую может отдать элемент, к его массе мало. На протяжении последних десятилетий ведутся исследования, направленные на создание элементов, при работе которых расходовались бы дешевые вещества с малой плотностью, подобные жидкому или газообразному топливу (природный газ, керосин, водород и ). Такие гальванические элементы называются топливными. Проблеме топливного элемента уделяется в настоящее время большое внимание и можно полагать, что в ближайшем будущем топливные элементы найдут широкое применение.
|
Массовая доля компонента, % | |||||||
Медно-фосфорные припои используются для пайки ювелирных изделий из латуни, нейзильбера, мельхиора, алюминиевой бронзы и медно-никелевых сплавов. Эти припои имеют высокую жидкотекучесть и обладают самофлюсующими свойствами, что позволяет производить пайку меди и некоторых ее сплавов без применения флюсов. Главным недостатком припоев является слабая пластичность, для увеличения которой в них добавляют олово и цинк. Марки медно-фосфорных припоев регламентируют многочисленные технические условия .
В табл. 1.8 приведены медно-фосфорные припои, применяемые в отечественном ювелирном производстве.
Таблица 1.8
Медно-фосфорные припои
|
Массовая доля компонента, % |
Рабочая темп.,°С |
||||||
1.4.4. Формы ювелирных припоев
Листы, ленты и проволока. Это традиционные формы припоев в ювелирном производстве. Одно из преимуществ подобных припоев состоит в том, что их состав является модификацией тех самых ювелирных сплавов, которые используются для изготовления спаиваемых деталей изделия. Поэтому их механические свойства (прочность, ударная вязкость, ковкость и способность к обработке) очень похожи. Листы и ленты можно нарезать на небольшие кусочки прямоугольного сечения, либо напиливать с получением стружки или порошка. Подготовка и нанесение данных типов припоя более подробно будет рассмотрена в разделе 1.6.5.
Листы и полосы, ламинированные припоем. Композитная форма припоя, состоящего из двух слоев: ювелирный сплав + припой. Цвет и проба золотых слоев композита должны совпадать. Слой припоя крепится к ювелирному сплаву путем диффузионной металлизации в печах с защитной атмосферой, либо металлизацией при прокатке между валами при высоком давлении. Обычно толщина слоя припоя составляет 5–15% от общей толщины композита.
Подобный фабрикат очень хорошо подходит для массового производства таких изделий, у которых штампованные из листового материала детали припаиваются к плоскому основанию, изготовленному из данного композита. Штампованные заготовки помещаются на покрытую припоем сторону листа, и сборка пропускается через конвейерную печь с защитной атмосферой. Припой под действием капиллярных сил втягивается с плоского основания в зазор. Недостатком подобных припоев является проблема повторного использования отходов композита. Это связано с наличием в слое припоя компонентов (цинк, олово, индий), понижающих температуру плавления сплавов.
Проволока, заполненная припоем. Этот фабрикат хорошо подходит для производства цепочек со спаянными звеньями. Литой штабик ювелирного сплава просверливают вдоль по центру; можно использовать также трубку непрерывного литья после зачистки ее внутренней поверхности. В отверстие слитка или в трубку вставляется стержень припоя. Полученный композит прокатывают в вальцах, протягивают в проволоку и отжигают. В результате пластического воздействия, дополняемого диффузией, происходящей в процессе отжига, сердцевина скрепляется с внешним слоем. В ходе последующей пайки цепи припой вытекает из сердцевины и втягивается под действием капиллярных сил в зазор стыка звена, образуя шов. Следует заранее продумать конструкцию стыка звена, чтобы обеспечить правильный характер течения припоя в процессе пайки. В идеале торцы проволочных звеньев срезаются так, чтобы при состыковке они совпадали и контактировали плоскостями, образуя практически нулевой зазор.
Паяльные пасты. В последнее время большой популярностью в ювелирной среде пользуются пастообразные припои на основе золота и серебра. Паяльные пасты представляют собой гомогенные смеси припоя в виде очень тонкого порошка предварительно приготовленного сплава узаконенной пробы с органической связкой. В основе связки лежат органические составляющие, которые устойчивы в течение длительного времени и полностью улетучиваются при нагревании. Наличие в составе пасты флюса зависит от источника нагрева. При пайке изделий в печи с защитной атмосферой флюс не нужен.
Для удобства дозирования паяльные пасты обычно упакованы в пластиковые шприцы. Размер шприцов варьируется от 3 до 30 мл. Шприцы могут поставляться со сменными иглами внутренним диаметром от 0,25 до 2,2 мм. Дозирующее оборудование может быть как ручным, так и автоматическим. Ручные дозаторы идеально подходят для работы в небольших ювелирных мастерских. Для нужд крупного поточного производства хорошо зарекомендовали себя электропневматические импульсные дозаторы.
Паяльные пасты стоят дороже, чем традиционные припои в виде полос и проволоки, т.к. в стоимость пасты входит изготовление порошка, смешивание его с флюсом и связкой, упаковка продукта. Однако у паст есть некоторые преимущества, позволяющие снижать себестоимость продукции:
1. Уменьшение брака паяных соединений, что особенно важно при пайке в печах. Кусочки припоя, разложенные вручную, часто слетают с изделий вследствие вибрации конвейерной ленты. Паста при нагревании остается на месте.
2. Возрастание производительности труда вследствие уменьшения времени нанесения пасты на стык. Кроме того, исчезает необходимость нанесения флюса.
3. Точность при нанесении.
4. Точность дозирования небольших количеств пасты, что уменьшает потери дорогостоящего припоя. С другой стороны, в области шва не образуется избыток припоя, что облегчает финишную обработку изделий.
5. Возможность снижения количества рабочих при одновременном повышении уровня производства.
6. Работа с пастами и дозирующим оборудованием не требует наличия у персонала высокой квалификации .
Простейшим тугоплавким припоем является чистая медь. Как известно, медь обладает сравнительно высокой прочностью и одновременно большой пластичностью; в литом состоянии медь имеет предел прочности 17-18 кг/мм2 при удлинении 30-35%; предел прочности деформированной меди в зависимости от количества примесей и степени наклепа меняется в пределах 24-25 кг/мм2; удлинение особо чистой меди достигает 50%. В связи с этим соединения, паянные медью, обладают высокой прочностью и не склонны к хрупкому разрушению.
Чистая медь отличается наибольшей электропроводностью после серебра, поэтому пайка медью желательна для таких соединений, которые не должны создавать дополнительного сопротивления прохождению электрического тока.
Медь хорошо смачивает поверхность железа и сталей (в том числе нержавеющих и жароупорных), никеля и никелевых сплавов, металлокерамических твердых сплавов и т. д. Это свойство меди дает возможность широко применять ее в качестве тугоплавкого припоя; однако высокая температура плавления меди (1083°) делает процесс пайки технологически сложным, поэтому чистая медь применяется в качестве припоя только при пайке в печах (с защитной атмосферой).
Для паяния газовой горелкой применять медь не желательно, так как образующиеся при этом пары воды (в результате восстановления водородом закиси меди) могут вызвать трещины в шве.
Медноцинковые припои. Как видно из диаграммы состояния, присадка цинка к меди вызывает снижение температуры плавления сплава; увеличение содержания цинка в сплаве до 40% снижает температуру плавления до 900°. Такой сплав можно применить в качестве припоя не только для пайки стали, но и для металла с более низкой температурой плавления, например для меди.
Медноцинковые сплавы с содержанием до 36-39% Zn представляют собой в равновесном состоянии однородный твердый раствор, имеющий такую же кристаллическую решетку, как и сама медь; эти сплавы обладают высокой пластичностью. Сплавы с содержанием от 39 до 46% Zn имеют двухфазную структуру, состоящую из кристаллитов; сплавы такого состава менее пластичны, причем чем больше относительное количество фазы, тем выше хрупкость сплава.
Увеличение содержания в сплаве цинка от 40 до 50% приводит к исчезновению кристаллов, и сплавы этого состава имеют однофазную структуру, состоящую из кристаллитов. Сплавы с 50-59% Zn имеют двухфазную структуру, которая при увеличении содержания цинка выше 59% снова переходит в однофазную структуру из однородных у-кристаллитов, обладающих малой механической прочностью и совсем незначительным удлинением.
Механические свойства медноцинковых сплавов находятся в полной зависимости от химического состава. Из системы медь - цинк в качестве припоев применяется довольно широкая группа сплавов с содержанием от 30 до 65% цинка. По отечественному стандарту выпускаются медноцинковые припои трех составов. Медноцинкозые припои выпускаются обычно в виде зерен, размером от 0,2 до 5,0 мм.
Сопоставляя химический состав медноцинковых припоев с диаграммой зависимости механических свойств от состава сплавов, можно видеть, что все припои этого класса, и особенно ПМЦ-36, обладают большой хрупкостью и недостаточной прочностью. Поэтому такие припои не имеют особо широкого распространения в промышленности.
Припой ПМЦ-36 применяется только в том случае, когда нужен недорогой твердый припой с возможно низкой температурой плавления, например для пайки латуни Л-62. Припой ПМЦ-48 пригоден для пайки медных сплавов, имеющих температуру плавления выше 900-920°, и то только в том случае, если паяное соединение не будет подвергаться ударным нагрузкам, вибрации и изгибу.
Припой ПМЦ-54 предназначен для пайки меди, бронзы и стали, для изделий, не испытывающих ударных и изгибающих нагрузок. В том случае, когда от паяного соединения требуются более высокая прочность и главным образом хорошая сопротивляемость удару и изгибу, в качестве припоя часто применяют латуни Л-62 и Л-68. Эти сплавы, наряду с более высоким пределом прочности (примерно 30 кг/мм2), имеют весьма большое относительное удлинение, достигающее 40%. Соединения, паянные латунью, могут подвергаться значительной деформации без разрушения. Латуни можно применять для пайки меди, сталей, никеля и чугунов.
При паянии обычными латунями неизбежно происходит выгорание цинка, который, как известно, при 906° уже кипит. Выгорание цинка сопровождается образованием весьма вредных для работающих паров окиси цинка и сильным ошлаковыванием припоя. Кроме того, снижение содержания цинка при выгорании приводит к повышению температуры плавления припоя, что в свою очередь требует нежелательного повышения температуры паяния. Для того чтобы несколько ослабить эти недостатки латуней в их состав иногда вводят небольшие присадки олова и кремния.
Добавка олова несколько понижает температуру плавления латуни и увеличивает жидкотекучесть ее. Добавка кремния уменьшает выгорание цинка, так как при расплавлении латуни кремний прежде всего окисляется сам и, соединяясь с флюсом, образует плотную пленку боросиликатов, защищающую цинк от испарения. В результате этого припои на медной основе, содержащие, кроме цинка, небольшие количества олова и кремния, обладают лучшими технологическими свойствами и обеспечивают более высокую плотность и герметичность шва.
Присадка к латуням олова и кремния вызывает изменение микроструктуры и свойств. Введение кремния в латунь Л-62 приводит к уменьшению в структуре количества а-фазы; при введении 0,6% Si а-фаза полностью исчезает и остается только одна в-фаза. Пластичность латуни Л-62 растет с увеличением содержания в ней кремния до 6%, при этом предел прочности на разрыв и на срез не уменьшается; наибольшей прочностью обладают сплавы, содержащие примерно 0,3% Si. Несмотря на то, что кремний несколько ухудшает растекаемость расплавленной латуни по поверхности металла, все же прочность шва при этом получается более высокой. Олово в отличие от кремния улучшает растекаемость латуни и способность заполнять паяемые швы.
Известно применение в промышленности медноцинковых припоев, улучшенных никелем, который повышает прочность и надежность паяных соединений. Однако температура плавления таких припоев значительно выше, чем у латуни без никеля.
